近年來,外泌體(exosomes)因其在生物醫學研究、疾病診斷及治療上的巨大潛力,已成為科研與產業界關注的焦點。美國作為全球外泌體研發與商業化的戰略重鎮,吸引眾多國際企業加速布局,力圖在這個高速發展的前沿領域中搶佔一席之地。
瑞歐佰藥近期協助南京科恩里斯生物醫藥有限公司自主研發的人臍帶間質幹細胞外泌體細分亞群 S1(備案號:041763) 與 S2(備案號:041762) 產品,成功取得美國食品藥品監督管理局(FDA)DMF II 型備案。

截至目前,瑞歐佰藥已成功協助恩康醫藥、科恩里斯等多家中國企業的外泌體產品完成美國 FDA DMF 登記,順利進軍國際市場。
美國DMF備案概述
Drug Master File(DMF),即藥品主文件,是提交給美國 FDA 的一種技術性資料檔案,詳細記錄藥品在生產、加工、包裝、儲存及批發等環節所使用的原料、製造設施、製程、包材及品質控制方法等核心資訊。
DMF 作為一種參考性資料,統一存放於FDA中央檔案室(Central Document Room, CDR),可用以支持多種註冊申請,包括臨床試驗申請(IND)、新藥上市申請(NDA)、學名藥申請(ANDA)、出口申請,以及上述申請的修訂與補充。
FDA 對DMF的分類如下:
DMF文件類型
| 類型 | 產品 / 資料 |
| Ⅱ 型 | 中間體、原料藥及藥品 |
| Ⅲ 型 | 包裝材料 |
| Ⅳ型 | 賦形劑、著色劑、香料、香精及其他添加劑 |
| Ⅴ型 | 非臨床數據資料及臨床數據資料 (*V 型須於遞交前先與 FDA 確認) |
美國DMF備案流程
對於非美國境內企業,美國FDA建議指定美國當地代理(US Agent)負責藥品主檔案(DMF)備案事宜,具體包括:擔任FDA的官方聯絡人,處理與DMF備案相關的所有事務;負責DMF文件的遞交、更新及後續維護;並及時回應FDA的各類詢問及審查要求。
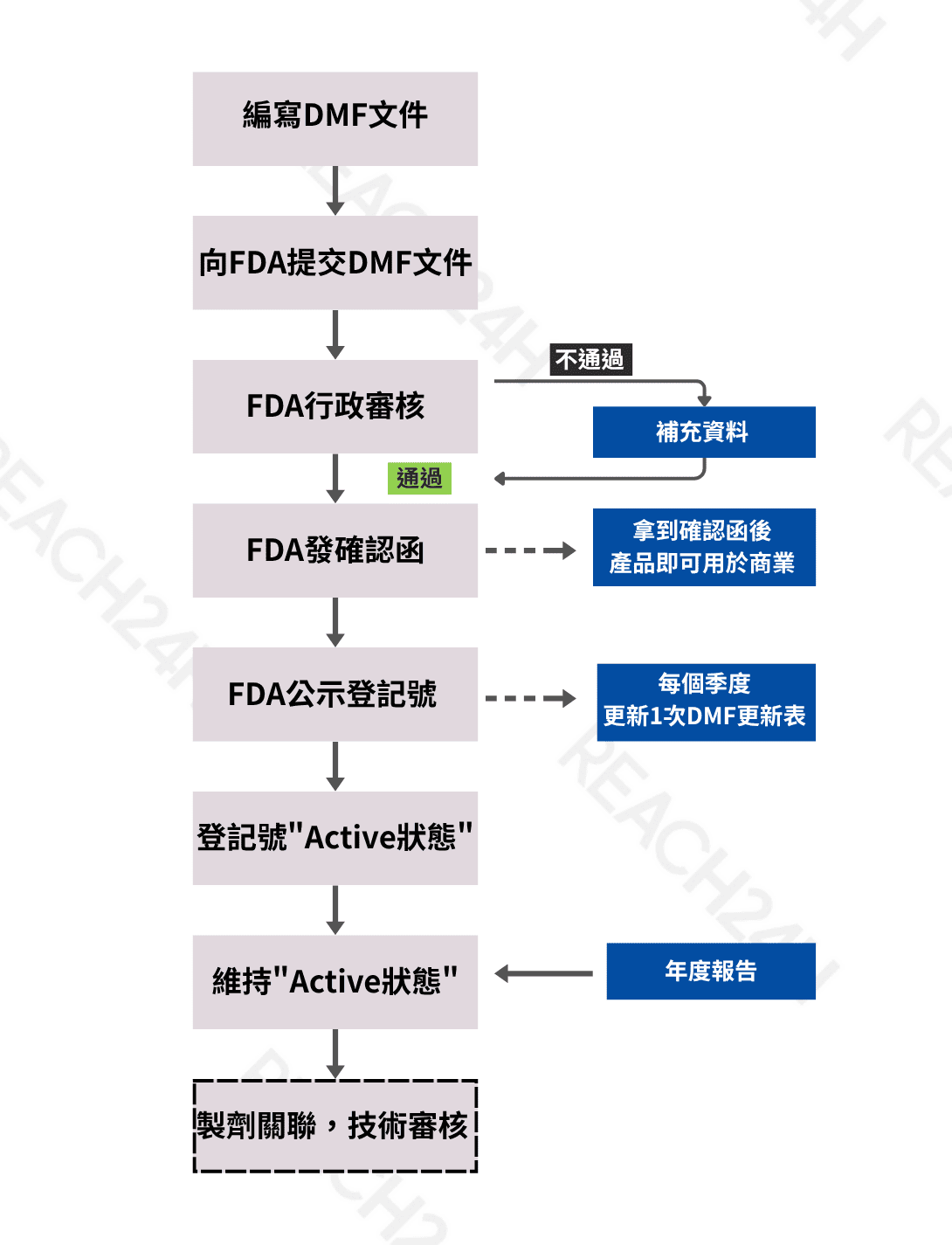 DMF備案流程
DMF備案流程
瑞歐佰藥成功案例
截至目前,瑞歐佰藥已成功完成近百項DMF II型備案,成功案例包含但不限於:
DMF II 類:層析介質類、外泌體、幹細胞株類、凍存液、培養基類、蛋白輔助因子類、化學原料藥等 30 余項
DMF III 類:高密度聚乙烯桶/瓶、凍存袋/多層共擠袋、聚丙烯組合瓶蓋系統/鋁塑組合蓋、離型膜、預充填注射器/筆式注射器、吸入劑及注射劑用瓶/安瓿瓶等 20 余項
DMF IV 類:藥用微載體、海藻酸鈣、膠化烴、纖維素類、聚乙二醇、明膠、聚維酮、蜂蜜、甘露醇等 20 余項
關於南京科恩里斯生物醫藥有限公司
南京科恩里斯生物醫藥有限公司(P.S.K Biosciences)是基於江蘇先聲藥業原轉化醫學與創新藥物國家重點實驗室的外泌體載藥技術平台,所成立的平臺型生物技術公司。專注於建立外泌體靶向遞送能力,特別是核酸類藥物穿腦及腫瘤組織靶向遞送,同時關注老年人面臨的廣泛且未被滿足的臨床治療需求,運用間質幹細胞來源外泌體(天然外泌體)獨立開展創新藥物研發。
相關文章:

