在化妝品新原料申報熱門程度不斷上升的背景下,具有安全食用歷史的原料(情形5),成為企業優先選擇的申報路徑之一,亦是食品、保健品等跨界企業重點關注的熱點類型。
瑞歐科技梳理了法規和指南中關於安全食用歷史的判定邏輯,並結合備案資料,分析當前常見具有安全食用歷史的新原料類型、申報趨勢及注意事項,供業界參考。
安全食用歷史的判定依據
根據《化妝品新原料註冊備案資料管理規定》,具備以下條件之一的,可被視為具有安全食用歷史的新原料:
取得中國大陸相關監督管理部門食品安全認證或其他相應資質的食品用原料;
經國內外相關監督管理部門、技術機構或其他權威機構發布的可安全食用的原料。
2025年6月25日,中國食品藥品檢定研究院發布了《化妝品新原料安全食用歷史研究和判定指南(試行)》(以下簡稱《指南》),對安全食用歷史進行了進一步的解析。
《指南》明確,具有安全食用歷史的原料具體包括:普通食品原料、地方特色食品原料、新食品原料、藥食同源原料以及可能有食用限制要求的保健食品原料。
| 安全食用歷史的原料 | 來源 | 相關證明資料 |
| 普通食品原料 | 普通食品,如糧食、瓜果蔬菜、肉類等 |
|
| 地方特色食品原料 | 在中國大陸部分地域有30年以上傳統食用習慣的食品 |
|
| 藥食同源原料 | 按照傳統既是食品又是中藥材的物質 |
|
| 新食品原料 | 新食品原料 |
|
| 保健食品原料 | 保健食品原料 |
|
相較於2024年5月31日發布的《化妝品新原料安全食用歷史研究和判定指南(試行)(徵求意見稿)》,《指南》將《徵求意見稿》中的常見食物原料也列入普通食品原料,同時補充增加了保健食品原料的資料要求,進一步明確了安全食用歷史的原料類型及資料要求。
已公示的新原料申報依據
2021年新規發布以來,已備案公示285個化妝品新原料(含相同原料名稱),可能具有安全食用歷史的新原料如下。
根據公開資料查詢,近60個化妝品新原料可能具有安全食用歷史依據。其中,吡咯並喹啉醌二鈉鹽、金耳(NAEMATELIA AURANTIALBA)子實體提取物、N-乙醯神經氨酸、岩藻糖基乳糖被多家企業多次備案,申報相當踴躍。
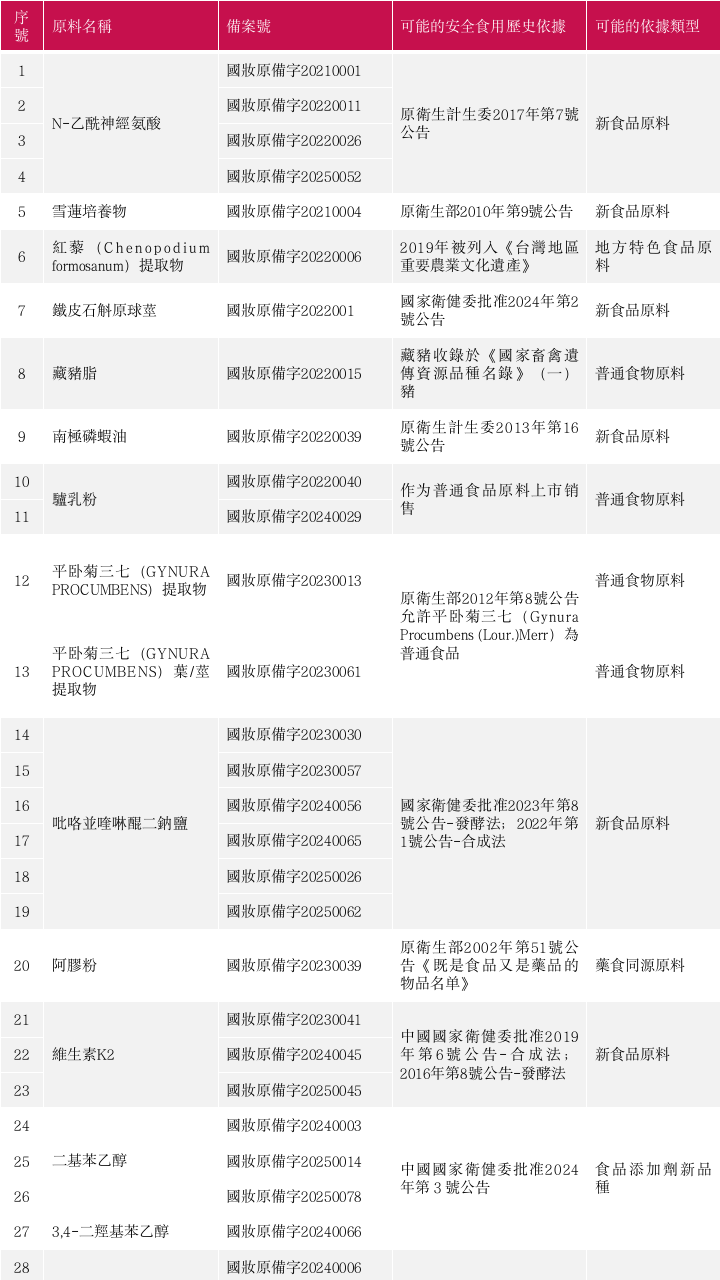
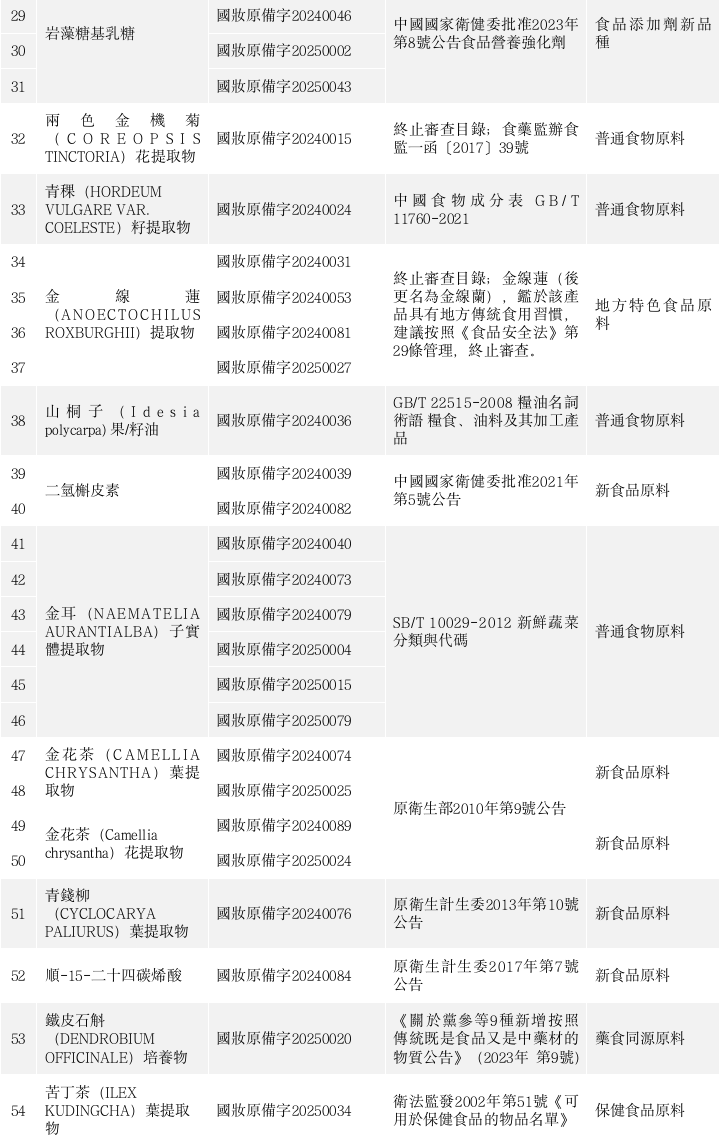

*註:以上原料可能的安全食用歷史僅依據公開資料查詢,不代表原料申報使用依據。
安全食用歷史的原料的依據和判定對化妝品新原料申報資料的準備至關重要,在準備充分的安全食用歷史證明資料的同時,還需考慮擬註冊備案新原料與安全食用歷史中載明的食品原料的一致性或相關性以及安全性。
《指南》還提出安全食用歷史主要用於減免系統毒性相關試驗項目,對於具有祛斑美白功能的新原料,無法排除其作為化妝品原料長期作用於人體皮膚的安全風險,應補充必要資料或試驗研究。
食品原料問答小知識
*摘自中國國家食品安全風險評估中心公布的「三新食品」與食藥物質常見問題解答
1.食品提取物能否作為食品原料使用?
食品原料成分複雜,食品提取製程多樣,對食品提取物的管理方式原則按照個案處理進行具體分析。食藥物質目錄中的物質可在食品生產加工過程中作簡單水提處理(未改變物質基礎)。由該水提液經物理過程(如冷凍乾燥、噴霧乾燥、真空乾燥、熱風乾燥等)製備得到的濃縮液、浸膏或粉體可作為原料用於普通食品生產,在終產品中的量經折算後應與原物質的傳統使用量一致。新食品原料使用應按照公告執行。有關問題,可以參考《國家衛生計生委政務公開辦關於新食品原料、普通食品和保健食品有關問題的說明》。
2.蛋白質酶解物能否作為食品原料使用?
原國家衛生計生委2013年第3號公告規定,「以可食用的動物或植物蛋白質為原料,經《食品添加劑使用標準》(GB2760)規定允許使用的食品用酶製劑酶解製成的物質作為普通食品管理」。可食用的動物或植物是指作為普通食品管理的動物或植物,如果是新食品原料來源的蛋白質通過允許使用的食品用酶製劑製成的物質,其不適宜人群應與該新食品原料保持一致,推薦食用量由生產企業按照該新食品原料的蛋白質含量折算,不適宜人群及推薦食用量應按照原公告要求進行標註。
如水解蛋黃粉(原衛生部2008年第20號公告)、玉米低聚肽粉(原衛生部2010年第15號公告)、小麥低聚肽(原衛生部2012年第16號公告),均以可食用的動物或植物蛋白質為原料,經GB2760規定允許使用的食品用酶製劑酶解製成,適合2013年第3號公告的規定,可作為普通食品管理。
瑞歐科技補充:儘管以上問答明確特定條件下部分食品提取物及蛋白質酶解物可作為食品原料使用,但在作為化妝品原料的安全食用歷史依據時還需進一步考慮原料的一致性,包括來源、製程、實際組成、使用規格等。
3.「三新食品」是什麼,我國如何管理?
「三新食品」指的是《食品安全法》第三十七條所列的「新食品原料」「食品添加劑新品種」和「食品相關產品新品種」。根據《食品安全法》及其實施條例、《新食品原料安全性審查管理辦法》、《食品添加劑新品種管理辦法》和《食品相關產品新品種行政許可管理規定》等,我國對於「三新食品」實行行政許可制度,即利用新食品原料生產食品,或者生產食品添加劑新品種、食品相關產品新品種,應當向國務院衛生行政部門提交安全性評估資料。國務院衛生行政部門應當自收到申請之日起六十日內組織審查;對符合食品安全要求的,准予許可並公布;對不符合食品安全要求的,不予許可並書面說明理由。目前,國家衛生健康委負責「三新食品」行政許可工作,指定國家食品安全風險評估中心負責組織「三新食品」的技術評審等工作。
瑞歐科技提醒您,企業在申報具有安全食用歷史的化妝品新原料時,應注意相關法規要求,確保產品順利合規。
相關文章:
《已使用化妝品原料目錄》動態調整機制落地:1號、3號新原料加入目錄II

