上周,美國 “MoCRA Cosmetic Direct” 的公測版已經上線,之前用於藥品註冊登記的提交系統(FDA Direct)更新為“FDA Direct. CDER Direct & Cosmetics Direct”。
據悉,該版本將作為美國食品藥品監督管理局 (FDA) 用於收集企業工廠註冊和產品列名資訊正式平臺上線前的beta測試版,最後再進行系統相關功能的修正。
由於FDA已經將化妝品工廠註冊和產品列名的截止期推遲到了2024年7月,企業有較充足的時間進行準備,因此需要進行工廠註冊和產品列名的企業也可以等待FDA正式官宣Cosmetic Direct平臺上線。
以下是瑞歐科技對公測版系統現有資訊和介面的介紹:
公測版系統介紹
提交系統可以提供3類帳戶的創建:藥品帳戶(CDER Direct)、化妝品帳戶(Cosmetics Direct)或者混合帳戶(Combined (CDER Direct and Cosmetics Direct);其中,化妝品帳戶的申請不需要提供鄧白氏編碼。
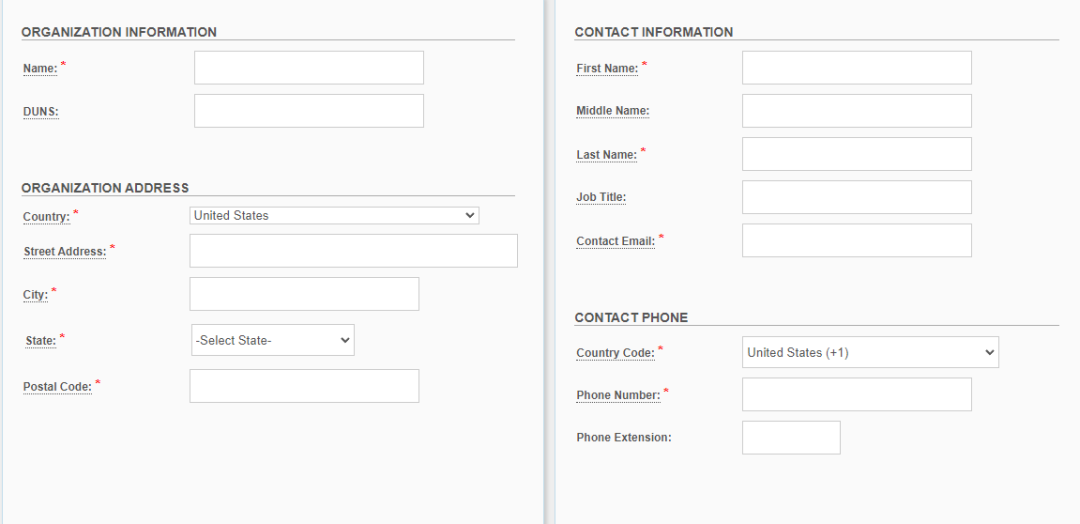
化妝品帳戶所需資訊介面
化妝品工廠註冊需要提供工廠所有者的資訊、FEI編號、相關的產品類別和責任人資訊,等等;
化妝品產品列名需要提供相關的產品資訊(責任人、成分清單等)、工廠註冊號、責任人資訊,等等。
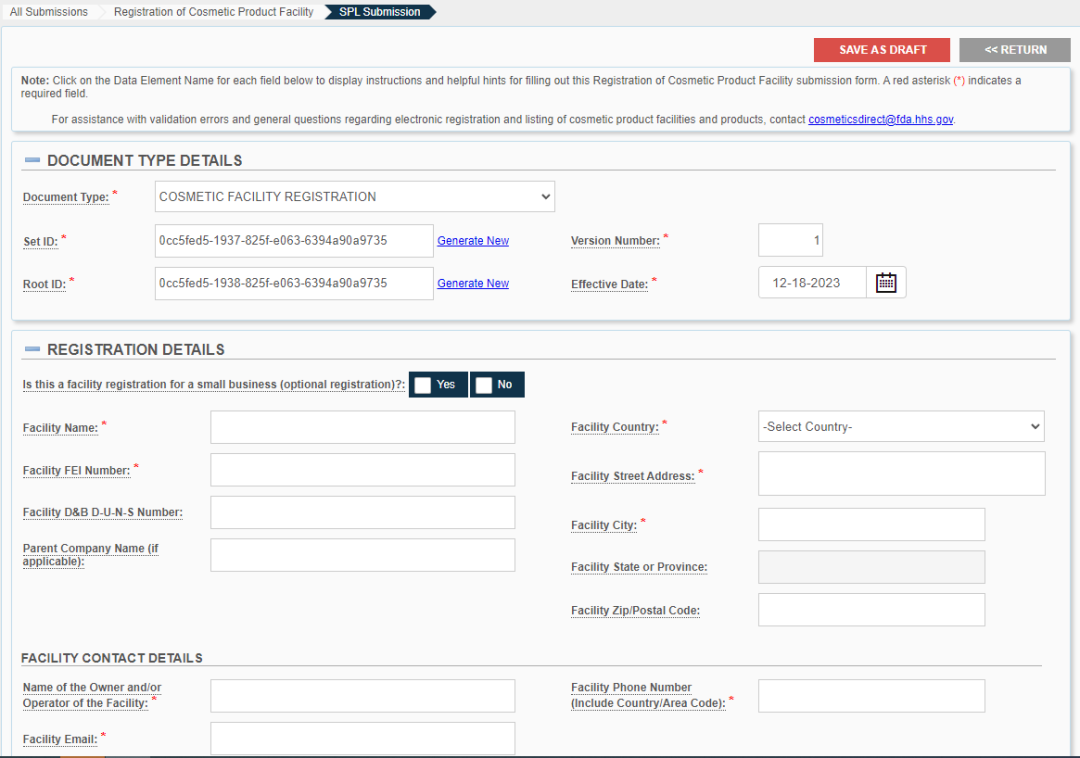
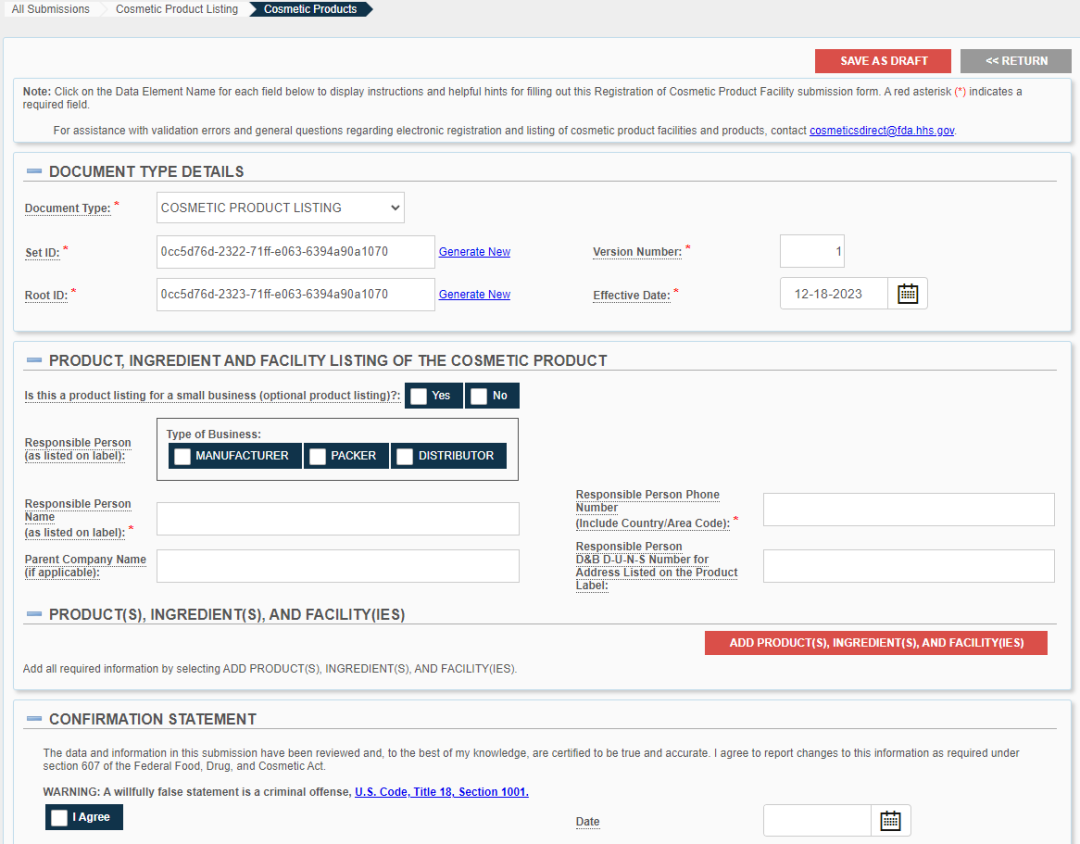 化妝品產品列名介面
化妝品產品列名介面
系統填報說明
根據2022年12月29日頒佈的MoCRA法規(《2022年化妝品法規現代化法案》),化妝品相關的生產工廠和責任人需要在規定的時間內進行工廠註冊和產品列名。
2023年9月15日,FDA發佈了化妝品電子提交系統指南草案。草案中對於電子提交系統的操作步驟做了詳盡的說明;此次開放的電子提交系統具體操作可以參考指南草案中的相關內容。

除了電子提交系統以外,FDA還接受紙質版的工廠註冊(FDA Form 5066-darft)和產品列名提交(FDA Form 5067-darft)。
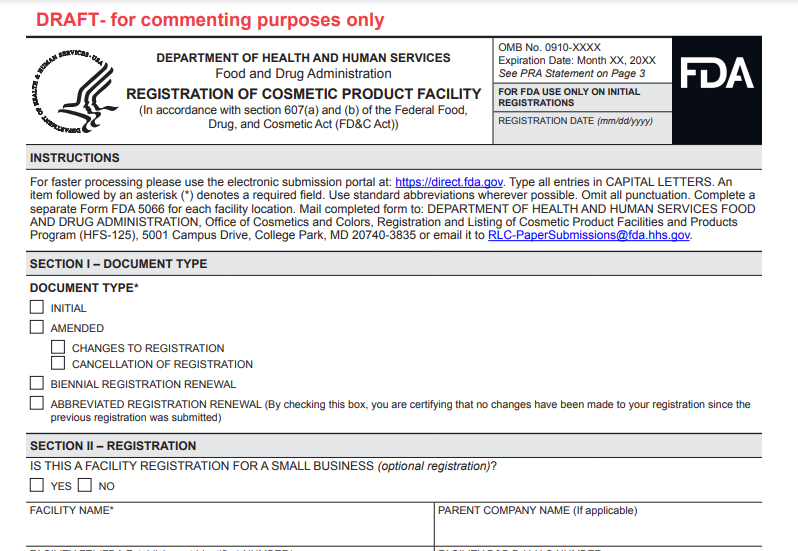

![]() 通過對比公測版與Form 5066和Form 5067的資訊可以發現,系統公測版的所需信息與Form 5066和Form 5067的要求基本一致。
通過對比公測版與Form 5066和Form 5067的資訊可以發現,系統公測版的所需信息與Form 5066和Form 5067的要求基本一致。
企業合規建議
瑞歐科技建議,相關企業可以根據MoCRA以及FDA相關指南的要求積極準備工廠註冊和產品列名的相關資訊和資料,並關注系統的正式上線。
具體提交資訊、豁免情況以及合規建議可以參考瑞歐科技推出的 「美國化妝品法規現代化法案——工廠註冊和產品列名重點解讀」的線上研討會。

