法規概述
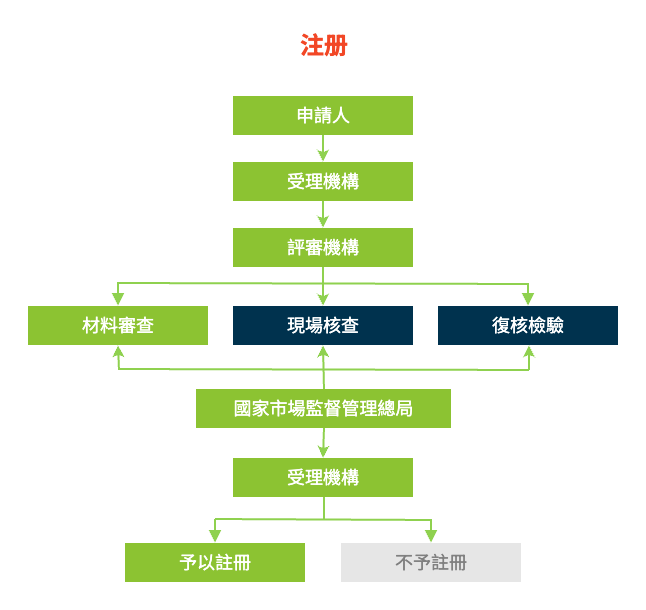
根據《食品安全法》規定,使用保健食品原料目錄以外原料的保健食品和首次進口的保健食品應當經國務院食品安全監督管理部門註冊;
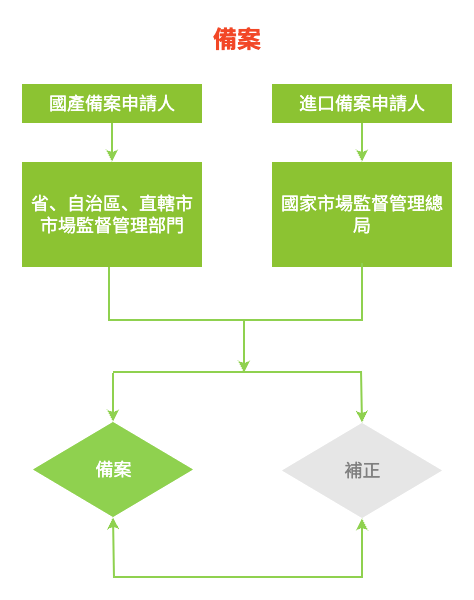
首次進口的保健食品中屬於補充維生素、礦物質等營養物質的,應當報國務院食品安全監督管理部門備案;
其他保健食品應當報省、自治區、直轄市人民政府食品安全監督管理部門備案。
自2017年5月1日起,對使用列入《保健食品原料目錄》的原料生產和進口保健食品的,國內生產企業和境外生產廠商應當按照《保健食品註冊與備案管理辦法》及相關規定進行備案。
主管部門
國家市場監督管理總局(SAMR)
相關法規
《保健食品註冊與備案管理辦法》
《輔酶Q10等五種保健食品原料備案產品劑型及技術要求》
《保健食品原料目錄 營養素補充劑(2020年版)》
《保健食品及其原料安全性毒理學檢驗與評價技術指導原則(2020年版)》
《保健食品原料用菌種安全性檢驗與評價技術指導原則(2020年版)》
《保健食品理化及衛生指標檢驗與評價技術指導原則(2020年版)》
进口流程進口流程
保健食品註冊
保健食品備案
我們的服務
法規咨詢
形式:網絡、電話、面對面
主要内容:
保健食品管理法規解讀
保健食品註冊與備案流程
保健食品註冊與備案策略分析
產品研發咨詢
國產保健食品備案
目的:獲得國產保健食品的上市許可
主要内容:
備案可行性研究
備案材料準備
備案材料專家審核
提交備案、取得備案號
進口營養素補充劑備案
目的:獲得進口營養素補充劑的上市許可
主要内容:
備案可行性研究
備案材料準備
備案材料專家審核
提交備案、取得備案號
保健食品註冊(國產/進口)
目的:獲得需註冊保健食品上市官方許可
主要内容:
註冊預評估:可行性、周期、費用
註冊卷宗製作
註冊測試監理
專家、評審部門溝通


