歐盟農藥法規:歐盟PPP-植物保護產品法規
歐盟農藥法規 Regulation (EC) No 1107/2009(以下簡稱歐盟 PPP 法規)於 2009 年頒布,用以取代舊有的法令 Directive 91/414/EEC,並自 2011 年 6 月 14 日起正式施行,是目前歐盟層級上農藥管理最重要的法規。
作為配套措施,Regulation (EU) 283/2013 與 Commission Regulation (EU) 284/2013 分別規定了歐盟對農藥活性物質與製劑產品登記時所需提交的資料要求。此外,歐盟委員會(EC)、歐洲食品安全局(EFSA)以及各個成員國亦頒布了一系列指南文件,作為對歐盟 PPP 法規的補充與細化,詳細說明實際登記操作的相關細節(如登記流程、審查費用、文獻檢索、資料保護、風險評估等)。
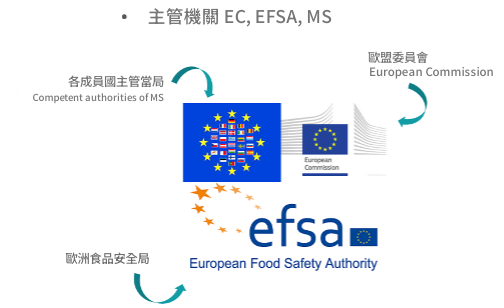
主要的監管機構包括歐盟委員會(European Commission, EC)、歐洲食品安全局(European Food Safety Authority, EFSA),以及各成員國的主管機關(Competent Authorities of Member States, MS)。
企業義務及因應策略
登記範圍
歐盟 PPP 法規的監管範圍涵蓋農藥活性物質、安全劑、增效劑、農藥製劑、輔助劑(例如桶混助劑)等。
根據歐盟 PPP 法規,農藥產品在歐盟的登記分為兩個層級:
一是歐盟層級的活性物質核准(原藥登記)
二是成員國層級的製劑產品授權(製劑登記)

登記主體
歐盟境内外的農藥生產商、貿易商等。
登記流程
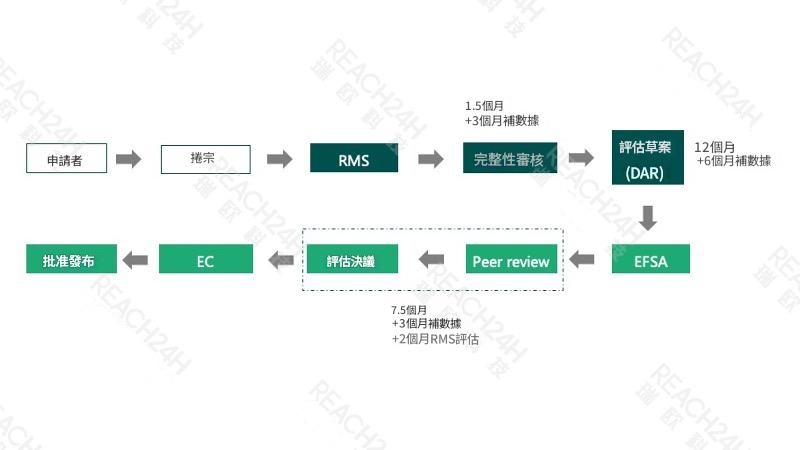
歐盟農藥活性物質核准評審流程
一般來說,對於一項新的農藥活性物質,歐盟層級會進行一次統一的評審,其評審流程如下圖所示:企業需先選定一個評估成員國(RMS)並向其提交一套完整的申請卷宗,由該評估成員國進行審查並出具評估報告草案。完成後,該報告草案將會送交歐洲食品安全局(EFSA)、歐盟委員會及其他成員國,並由 EFSA 組織進行草案的公開評議。
當所有成員國達成一致意見後,該評估結果即會獲得通過。因此,一旦某項活性物質獲得批准並生效,該批准會在整個歐盟層面獲得認可。而該已獲批准的物質來源,將成為原藥的參考來源,並享有 10 年的批准有效期。
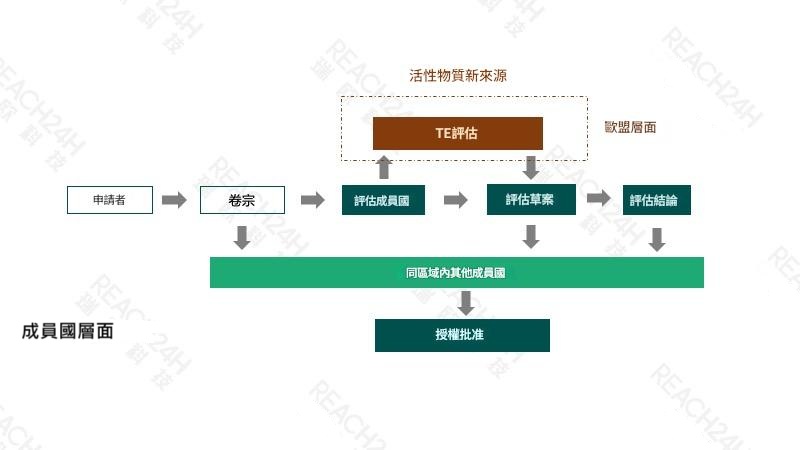
 歐盟原藥等同性評估(歐盟 TE 評估)
歐盟原藥等同性評估(歐盟 TE 評估)除了原藥參考來源之外,其他非專利原藥若要進入歐盟市場,必須與已獲歐盟批准的參考來源進行等同性(Technical Equivalence, TE)評估。當歐盟 TE 評估通過後,即在歐盟層面有效,該原藥可於整個歐盟市場銷售。
一般來說,以下三種情況需進行歐盟 TE 評估:
新原藥來源為參考來源生產商以外的製造商;
原參考來源或已獲 TE 批准來源由小試或中試規模轉為大規模生產;
原參考來源或已獲 TE 批准來源更改了生產工藝或生產工廠地點。
產品授權
製劑產品授權屬於成員國層級,產品若要在市場上銷售,必須取得所有目標銷售國的授權許可。
為了減少重複審查、縮短產品投放歐盟市場的時間,歐盟 PPP 法規引入「區域評估系統」,即在產品登記中採用區域性評審制度。根據相關規定,歐盟依據農業氣候條件劃分為北區、中區與南區三個區域,進行核心卷宗的統一區域評估。除了核心卷宗,各成員國亦可依自身農業環境條件提出額外的資料要求(例如藥效、殘留、環境歸趨等),這些附加資料包含於成員國卷宗中,由各該國單獨審查。對於不受農業氣候條件影響的產品(如室內使用:採後處理、溫室、倉儲用途,以及種子處理產品),則視整個歐盟為單一區域進行製劑登記評估。
企業申請區域授權的具體流程如下圖所示。申請製劑登記時,所使用的原藥來源必須為已批准的參考來源,或是經 TE 評估確定與參考來源等同的新來源(TE 來源)。此外,在產品授權評估的過程中,產品的卷宗、評估草案與最終決策,除了由評估成員國(RMS)審核外,還會同步發送給同一區域內的其他成員國,並接受這些成員國的意見。因此,當產品在一個成員國取得授權後,企業即可申請區域互認,將產品輸出至同一區域內的其他國家,藉此大幅簡化授權流程與成本。
評估成員國(RMS)選擇
在申請原藥 TE 評估或製劑產品授權時,企業需選定一個主評估國(RMS)。選擇 RMS 時,主要需考量以下因素:
 歐盟農藥再評審
歐盟農藥再評審
根據歐盟 PPP 法規,農藥活性物質在首次獲得批准後,通常享有 10 年的有效期(不包括低風險農藥與候選替代物質)。在該活性物質的有效期到期前 3 年,企業需提交物質再評審申請,以確保產品能持續合法銷售於市場上。
產品登記的有效期與活性物質的批准狀態息息相關,只要活性物質仍處於批准狀態,產品登記就會持續有效。在活性物質完成再評審並獲得續期批准後,相關的產品也必須進行續展登記。
歐盟農藥登記資料保護
為了保障登記申請人的權益,歐盟對用於農藥登記的資料設有保護機制。資料保護期通常自製劑產品授權批准之日起計算。
在一般情況下,產品首次批准所使用的資料(包含原藥核准與製劑授權所提交的資料)享有 10 年的保護期;若為低風險農藥,則享有 13 年的保護期。至於再評審時提交的資料,則享有 30 個月的保護期。
我們的服務
歐盟原藥等同性評估(歐盟 TE)
歐盟農藥新活性成分登記
活性物質再評審申請
歐盟農藥製劑產品授權(Article 33 & 34 登記)
Data Matching 評估
QSAR 報告
內分泌干擾風險評估
產品合規分析 / 資料缺口分析報告
資料評估 / 缺口分析 / 豁免分析 / 專利分析
GLP 實驗代理與監理
法規綜合諮詢與客製化培訓服務
歐盟分公司設立
歐盟 PPP 農藥登記項目經驗
在歐盟農藥登記方面,我們是國內最早開始研究原藥等同性評估,並成功取得批准信的機構之一,同時也被列入歐盟農藥登記 CADDY 卷宗編寫服務供應商名單。截至目前,瑞歐已成功協助企業完成近 200 件歐盟 TE 申請,涵蓋產品超過 100 種。經過十多年合規實戰經驗,我們的團隊已建立起非常豐富且成熟的官方資源渠道,至今已在歐盟十多個國家遞交申請並順利通過審核。
此外,英國、荷蘭、法國、義大利、比利時、德國、波蘭、奧地利、捷克、愛爾蘭等國的政府機關與我們長期保持良好合作關係,其中英國與荷蘭等國的官方代表更是連續多年擔任講者,出席由瑞歐科技主辦的全球化學品法規高峰會。
我們的優勢
扎實的專業技術能力
超過 10 年的歐盟農藥管理法規合規實踐經驗,累積了豐碩成果,具備獨立完成歐盟農藥登記項目的專業服務能力。
豐富的成功專案經驗
瑞歐已成功協助國內外企業完成數百件歐盟 PPP 登記申請,涵蓋產品超過 100 種。其中,中國農藥企業 Top100 中,有高達 80% 為我們的合作夥伴。
合理透明的收費標準
充分考慮中國企業的實際情況,提前說明收費標準,採用項目打包收費制,費用合理且透明。專案採分階段收費模式,有效減少不必要的成本支出。
用「心」做事,以「專業」服人
瑞歐不僅憑藉多年經驗與紮實的技術能力,協助企業完善登記資料、提升資料的品質與可靠性,更擅長運用專業技術與國外農藥評審機構進行有效溝通,協助企業爭取資料豁免,進一步降低登記費用與時程成本。
歐盟官方關係與語言溝通優勢
瑞歐於愛爾蘭設有子公司,與歐盟 EFSA、英國 HSE、荷蘭 Ctgb 等官方機構及專家建立了長期穩定的合作與溝通機制,可協助企業量身打造高效率、高品質的專案方案,大幅提升登記項目的服務品質與效率。


